突触核蛋白(α-synuclein)是一种因与帕金森病有关而最为人所知的蛋白质。α-突触核蛋白遍布人体组织,其中在大脑中的浓度最高。虽然α-突触核蛋白的具体功能尚不完全清楚,但有证据表明它参与了大脑神经递质的释放。这种蛋白质是人体的正常组成部分。然而,当它的形状发生变化时,就会引发问题,变成有毒的蛋白质,从而引发疾病。
α-突触核蛋白在帕金森病中起什么作用?
帕金森病是一种随时间推移而恶化的运动障碍。研究表明,α-突触核蛋白可能在该疾病中发挥重要作用。
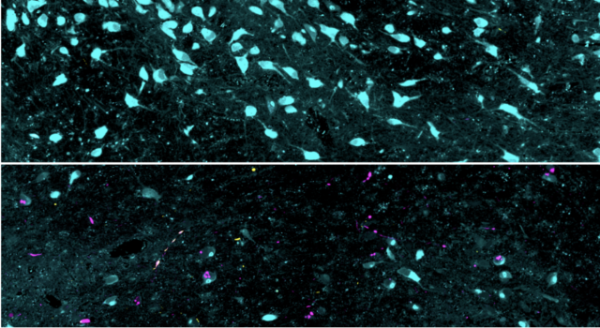
顶部图像以蓝色显示健康的神经元,而底部图像以洋红色描绘了这些神经元的大量损失以及 α-突触核蛋白的积累。
在帕金森病中,α-突触核蛋白会变形,导致其粘连在一起,形成有毒的蛋白质团块(或聚集体),即路易体。1这些团块会干扰脑细胞的功能,导致其功能障碍甚至死亡。
我们尚不清楚究竟是什么原因导致α-突触核蛋白改变其形状,但有一种细胞类型容易受到这种变化的影响,那就是多巴胺分泌细胞。多巴胺分泌细胞的缺失会导致帕金森病的标志性症状:震颤、肌肉僵硬和运动迟缓。
α-syn 的功能尚不完全清楚,但以下功能似乎与该蛋白质的一些活性相符:
通过降低蛋白激酶C活性抑制多巴胺能神经元的凋亡
蛋白激酶C (PKC) 是一种丝氨酸-苏氨酸激酶,它能够磷酸化不同的靶蛋白,从而调控多种机制,例如细胞凋亡。这种激酶对氧化应激非常敏感,并会在多巴胺能细胞中引发凋亡级联反应。α-Syn 似乎是一种 PKC 下调因子,可以保护多巴胺能细胞免于凋亡。具体而言,研究表明 α-syn 可以通过下调 PKCd 的表达来关闭蛋白水解级联反应。在多巴胺能细胞中,α-syn 通过使核因子 κB 失活来降低 PKCd 的转录。因此,α-syn 可以被认为是多巴胺能细胞中的一种神经保护蛋白。
血糖水平的调节
除了神经元之外,α-突触核蛋白(α-syn)也已在许多其他细胞类型中被发现,尤其是那些参与分泌过程的细胞。α-突触核蛋白与含胰岛素的分泌颗粒相互作用,从而降低胰岛素分泌。α-突触核蛋白与胰岛素分泌颗粒的K ATP通道相互作用,可抑制葡萄糖刺激引起的胰岛素分泌。这些发现表明 α-syn 在糖尿病中发挥着作用,而糖尿病与 PD 等其他退行性疾病一样,是由分泌过程调节问题引起的。此外,研究表明,在 2 型糖尿病 (T2D) 中,淀粉样变性蛋白会沉积在胰腺 β 细胞中,这些患者最有可能患上 PD,因为 α-syn 可能与淀粉样蛋白原纤维结合,在多巴胺能细胞中形成不可逆的破坏性复合物。在人类和小鼠中,血清中较高水平的 α-syn 与葡萄糖代谢直接相关。α-syn 似乎可以通过一种名为 LPAR2-CD90 的 G 蛋白偶联受体促进葡萄糖进入脂肪组织和骨骼肌。
钙调蛋白活性的调节
钙调节蛋白,也称为钙调蛋白 (CaM),是一种信使蛋白,它通过与 Ca2+离子结合而被激活,并触发各种机制,例如与短期和长期记忆有关的机制。研究表明,野生型 (WT) 和突变型 α-syn 不仅可以在体外而且可以在体内与 CaM 相互作用。这种依赖于钙离子的相互作用会导致 α-syn 纤维化。因此,钙离子可以通过诱导 α-syn 和 CaM 之间的相互作用来调节 α-syn 功能。此外,在没有 α-syn 的情况下,CaM 对 G 蛋白偶联受体激酶 5 (GRK5) 具有抑制作用。另一方面,在存在 α-syn 的情况下,CaM 会刺激 GRK5 活性。综上所述,α-syn 通过控制 CaM 从抑制剂转化为激活剂,反之亦然,间接参与 GRK 的调节。
促进敏感因子附着蛋白受体复合物在体内和体外的组装
神经递质在1分钟内从突触前囊泡分泌数次。神经递质的顺序分泌途径与膜融合蛋白的有序活性密切相关。N-乙基马来酰亚胺-敏感因子附着蛋白受体 (SNARE) 复合物的组装和拆卸是每个神经递质释放周期必须重复的反应之一。然而,SNARE 蛋白的组装和拆卸伴随着中间 SNARE 蛋白结构的形成,这些中间 SNARE 蛋白结构处于未折叠状态,易于降解。α-Syn 通过其分子伴侣活性参与这些组装/拆卸周期中 SNARE 结构的维持。具体而言,α-syn 与 SNARE 蛋白突触小泡蛋白-2/囊泡相关膜蛋白 2 的直接相互作用会抑制 SNARE 复合物的组装。因此,α-syn 功能障碍可能导致神经系统问题,因为其缺乏会减少 SNARE 复合物的组装。在 SNARE 复合物组装过程中,未折叠的胞浆 α-syn 单体与突触前膜结合,形成 α 螺旋折叠的 α-syn 同源物复合物,即 SNARE 复合物的伴侣组装,从而对突触前末端起到神经保护作用。此外,与单体不同,α-syn 的大型寡聚体是有害的,它们会与一种名为突触小泡蛋白-2 的特定 SNARE 蛋白的 N 端结构域结合,阻止 SNARE 复合物的组装,从而导致神经退行性。
充当分子伴侣
α-Syn 被认为是一种分子伴侣蛋白,因为它含有与 14-3-3 蛋白同源的区域,而 14-3-3 蛋白又能与许多细胞蛋白相互作用。14-3-3 蛋白是细胞质分子伴侣家族的成员,它们可以磷酸化其靶标的结合位点,包括 PKC、Bcl-2 相关死亡启动子 (BAD) 和细胞外信号调节激酶 (ERK)。研究表明,α-syn 还可以与 14-3-3 的靶标结合。此外,在热和化学条件下 α-syn 的过表达会阻止靶标蛋白的聚集,这也是提示 α-syn 是一种分子伴侣的另一个原因。α-Syn 分子伴侣活性依赖于其 N 端和 C 端区域。 N 端结构域负责 α-syn 与底物蛋白的相互作用,从而形成一个大的复合物,而 C 端结构域负责该复合物的溶解。
维持多不饱和脂肪酸水平
大脑是脂肪组织之后第二大脂质来源,富含两种多不饱和脂肪酸 (PUFA):花生四烯酸和二十二碳六烯酸,约占大脑脂肪酸的 20%。酰基辅酶 A 合成酶 (ACSL) 通过在脂肪酸骨架上添加酰基,从其他可用的脂肪酸原料中合成这些脂肪酸。将花生四烯酸整合到磷脂中的 ACSL6 同工酶受 α-突触核蛋白 (α-syn) 调控。因此,α-突触核蛋白可能参与底物向 ACSL 的呈递,从而控制大脑的 PUFA 水平。
充当抗氧化剂并防止囊泡中不饱和脂质的氧化
多巴胺能神经元的氧化应激可能引发导致帕金森病 (PD) 的病理损伤。这种损伤是由不饱和磷脂的氧化引起的,氧化会导致细胞膜和细胞内膜受损。多巴胺能神经元对此类损伤的敏感性是由这些细胞内的多巴胺氧化代谢引起的。因此,富含不饱和脂肪酸的多巴胺能细胞膜更容易受到氧化和损伤。单体形式的 α-突触核蛋白 (α-syn) 通过与脂质膜相互作用可以保护脂质免受氧化,但纤维状形式的 α-突触核蛋白 (α-syn) 则不具备这种能力。因此,单体 α-syn 似乎可以作为一种抗氧化剂,在多巴胺能神经元中发挥重要作用,保护它们免受氧化损伤。α-syn 可能不是一种抗氧化剂,但可以通过与线粒体膜上的细胞色素 c 氧化酶结合并抑制细胞色素 c 从线粒体释放到胞质溶胶来防止细胞凋亡。因此,胱天蛋白酶无法被激活,从而无法触发细胞凋亡。此外,过氧化氢不能损害表达 α-syn 的神经细胞,但它对对照细胞有毒性。在没有 α-syn 的情况下,过氧化氢会激活 c-Jun 氨基末端激酶 (JNK),它是丝裂原活化蛋白激酶 (MAPK) 家族的成员,可在氧化应激条件下促进细胞凋亡。 α-Syn 通过激活 JNK 相互作用蛋白/胰岛脑 (JIP-1b/IB1) 作为 JNK 通路的抑制剂,可以保护细胞免受损伤。
神经元分化
由于 α-syn 在功能和结构上均与分子伴侣蛋白 14-3-3 同源,它不仅可以与 14-3-3 本身相互作用,还可以与其配体(例如 Ras 的激酶抑制因子)相互作用。因此,α-syn 被认为通过激活 Ras 参与不同的细胞功能。Ras 的活化形式可以激活一系列事件,包括 ERK/MAPK 通路,该通路参与将生长因子信号从细胞受体发送到细胞核中的转录因子。此外,α-syn 通过与 Ras 相关的 GTP 酶 Rab3a 相互作用与膜结合。这种分子结合已通过抗 Rab3a 抗体得到证实,该抗体可将结合的 α-syn 从膜上解离,这表明 Rab3a 参与稳定突触体上的 α-syn。
多巴胺生物合成的调节
α-Syn 作为酪氨酸羟化酶 (TH) 活性的下调剂,可以调节多巴胺的产生并控制其细胞水平。因此,α-syn 表达降低或聚集会导致多巴胺合成增加,从而引发由多巴胺代谢引起的氧化应激。α-syn 对 TH 活性的抑制作用并非直接作用,而是依赖于 α-syn 与蛋白磷酸酶 2A (PP2A) 之间的相互作用。这种 α-syn 与 PP2A 的相互作用激活了 PP2A 磷酸酶的功能,导致 TH-Ser 40 残基去磷酸化,从而抑制 TH。 α-突触核蛋白(α-syn)过表达和突变均已被证明会上调其对甲状腺激素(TH)和多巴胺水平的抑制作用,从而导致多巴胺合成和释放下调。另一方面,研究显示,α-突触核蛋白(α-syn)过表达会增加非受体酪氨酸激酶家族成员src的活性,从而导致蛋白质过度磷酸化和神经退行性病变。Scr可以磷酸化PP2A作为底物在Tyr 307位点的磷酸化,从而抑制其磷酸化活性。
调节囊泡运输
突触囊泡形成途径始于在诸如网格蛋白等充当球形框架的外壳蛋白的帮助下,囊泡膜弯曲成芽状。随后,在SNARE蛋白的帮助下,囊泡被靶向到特定的分泌点。在此途径中,α-突触核蛋白(α-Syn)选择性地与弯曲的膜结合,从而调节突触中的囊泡运输。α-突触核蛋白可能同时减少囊泡从突触循环到突触前区域的数量和速度。囊泡动力学的降低对于突触稳态至关重要,因为α-突触核蛋白的缺失会通过增加囊泡运输来扰乱这种平衡。
α-突触核蛋白(α-syn)的这种调节作用源于其特殊的结构。在脂质体存在下,α-突触核蛋白的11个残基重复序列可以折叠成膜结合螺旋,该螺旋被中间的非结构化片段隔开。α-突触核蛋白能够检测囊泡池,因为它对脂质双层膜具有亲和力。这意味着,由于α-突触核蛋白能够感知囊泡的膜曲率,因此在含有大量小脂质体的囊泡池中,其高浓度存在的可能性比在细胞其他部位更高。
