突触核蛋白:结构
发布时间:2025-10-26 22:54:46 点击次数:
突触核蛋白是一种由 140 个氨基酸组成的蛋白质,含有突触核蛋白家族独有的序列基序。
该蛋白质的结构包含三个不同的结构域:
1) N 端(残基 1-60),
2) 中心 NAC 结构域(残基 61-95)
3) C 端(96-140)。
N 端区域包含与 PD 相关的所有突变,由形成两亲性 α 螺旋的保守残基重复序列 (KTK(E/Q)GV) 组成。重复序列的大小及其脂质结合能力使肽能够形成三个螺旋转角并直接接触膜。极性 C 端由三种残基(脯氨酸、天冬氨酸和谷氨酸)的丰度定义,其保守性低于 N 端。 C 端缺失会导致 α-突触核蛋白聚集增加,这表明该结构域调节蛋白质积累。最后,NAC 结构域含有许多疏水性氨基酸,这些氨基酸是 α-突触核蛋白聚集的关键。
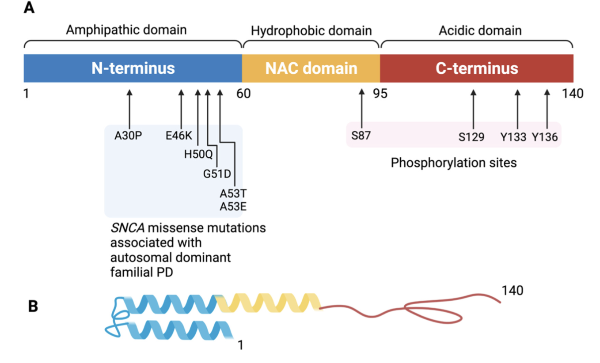
α-突触核蛋白结构域。(A)α-突触核蛋白结构域。标生长因子N端、NAC区和C端的氨基酸残基以及已知突变位点的氨基酸残基。该140个氨基酸蛋白分成三个不同的结构域。N端两亲结构域(蓝色)受包含与常染色体显性帕金森病相关的主要结构α-突触核蛋白基因突变(A30P、E46K、H50Q、G51D、A53T、A53E)影响氨基酸残基。N端区域螺旋具有折叠因果,负责膜结合。胶原性非淀粉样蛋白斑β组分(NAC)黄色结构域负责促进聚集。C端结构域(红色)形成酸性尾部,包含主要位于Ser129的磷酸化点位。C端结构域调节α-突触核蛋白的聚集。(B)α-突触核蛋白纯化的三级结构。
关于α-突触核蛋白的天然结构存在相互矛盾的研究;最初该蛋白质被描述为未折叠的,但最近的发现表明它在溶液中仍保持折叠状态。例如,Wang等人(2011)将α-突触核蛋白描述为稳定的螺旋折叠四聚体,不含脂质双层或胶束。对于发现α-突触核蛋白多种构象,最合理的解释是该蛋白质以多种寡聚状态存在,并处于动态平衡状态。
