将 α-Syn 样本 (10 μg) 注射至纹状体(前后方向,0.2 mm;内侧-外侧方向,-2.0 mm;背腹方向,-2.6 mm)。接种 3 个月后,用异氟烷麻醉小鼠,断头处死。用 10% 福尔马林中性缓冲液(Wako)固定脑组织,并用 Leica VT1200S 切片机制成 50 μm 切片。
采用针对 Ser-129 位磷酸化的 α-syn 的多克隆抗体 1175(1:2000)进行免疫组织化学染色。
ThT染色:切片用80%乙醇中的0.1% ThT染色15分钟,然后用80%和70%乙醇各1分钟,再用蒸馏水清洗两次。
使用BZ-X710(Keyence)观察并记录α-Syn病理。
使用BZ-X分析仪(Keyence)对α-Syn病理进行量化,并以磷酸化α-Syn沉积物覆盖的面积占总面积的百分比表示。
为制备肌酰不溶性级分,将脑组织置于干冰上速冻,并储存于-80°C。
将超声处理的 α-syn 原纤维注射到小鼠脑内,3 个月后通过磷酸化 α-syn 的免疫组织化学方法检查病理变化。与接种未处理的 α-syn 原纤维相比,碎裂的 α-syn 原纤维(例如超声处理 180 秒的原纤维)引起了更广泛的种子依赖性磷酸化 α-syn 聚集和更大范围的增殖。
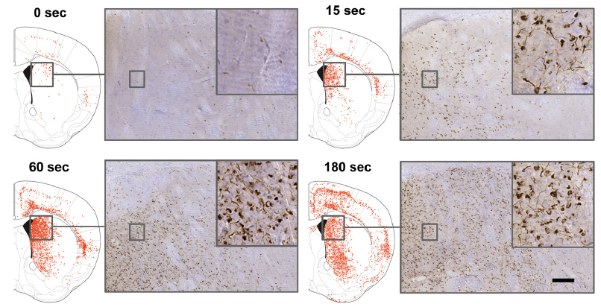
将 α-syn 样品 (10 μg) 注射到纹状体 ( Str ) 3 个月后观察到的小鼠脑中磷酸化 α-syn 病理的分布。使用 Ser( P )-129 抗体通过免疫组织化学评估磷酸化 α-syn 病理。显示了注射了 α-syn 原纤维的脑前囟 0.62 毫米水平的典型图像 (右图)和磷酸化α- syn病理示意图 (图像旁边的左图)。红点表示磷酸化α - syn 病理。比例尺= 100 μm。
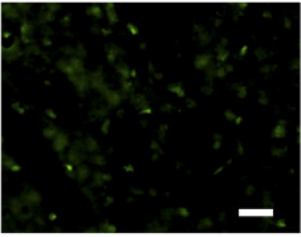
在注射原纤维的小鼠脑中观察到了硫代黄素 T 阳性聚集体(图 7C )。
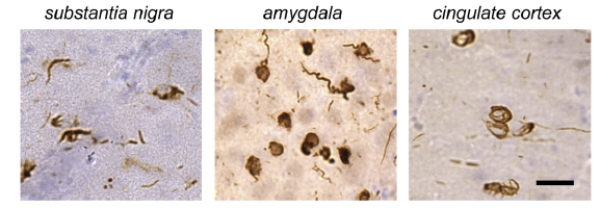
在纹状体、杏仁核、黑质、躯体感觉皮层、扣带皮层和胼胝体中观察到了类似路易体和路易神经突的磷酸化 α-syn 沉积物。
超声处理 α-syn 原纤维对小鼠脑中磷酸化 α-syn 的积累有显著影响。至于 α-syn 积累的传播模式,超声处理 60 秒和 180 秒的样品之间几乎没有差异,而超声处理 15 秒的样品引起的磷酸化 syn 病理不如超声处理 180 秒的样品引起的磷酸化 syn 病理广泛。
碎片化程度更高的 α-syn 原纤维也更有能力引起小鼠脑中种子依赖性的 α-syn 聚集。可能 α-syn 原纤维的更广泛的碎片化使它们能够更有效地融入细胞,从而由于 α-syn 聚合加速而导致朊病毒样繁殖的播种活性增加。
